Escrito por Dr Hannah K Shorrock
Editado por Dr Larissa Nitschke
Traduzido por Ana Carolina Martins
Composto modificadores de “splicing” podem regular se a terapia gênica está ou não ativa
A terapia gênica é uma estratégia terapêutica incrivelmente versátil que pode ser usada para tratar doenças monogênicas. A terapia gênica pode inativar ou silenciar transcrição de genes mutantes, editar o genoma para reparar genes mutantes ou expressar cópias saudáveis de genes de doenças. A terapia gênica geralmente é realizada usando um vetor viral, mas isso pode levar a vários problemas, como falta de controle sobre os níveis de expressão, alterações no DNA ou RNA diferentes dos efeitos desejados e vetores virais se tornando parte do DNA humano. Esses efeitos adversos poderiam ser minimizados se a expressão da terapia gênica pudesse ser rigorosamente controlada. Foi isso que a equipe liderada pelo Dr. Davidson se propôs a fazer: eles desenvolveram um interruptor para controlar se a terapia gênica está ativa ou se está desligada.
O grupo iniciou sua busca por um interruptor para terapia gênica identificando pequenas moléculas capazes de alterar o splicing. O splicing é o processo no qual um transcrito de RNA mensageiro recém-sintetizado é convertido em um RNA mensageiro maduro. Durante o splicing, as porções do código genético no RNA mensageiro recém-criado, chamadas de íntrons, são removidas entre as seções chamadas de éxons. Ao unir os éxons novamente, um mRNA maduro é produzido (mRNA). No tratamento da Atrofia Muscular Espinhal (AME) – uma doença do neurônio motor com início na infância – existem pequenas moléculas regulamentadas que agem ligando-se a uma posição onde um transcrito de mRNA recém-sintetizado normalmente seria unido para gerar o transcrito maduro. O grupo aproveitou esse sistema para controlar a inclusão ou exclusão de material genético que sinaliza se uma proteína deve ou não ser produzida a partir do RNA transcrito. Se nenhuma proteína for produzida, então a terapia gênica não seria expressa e estaria em um estado desligado, se uma proteína for produzida, então a terapia gênica estaria ativa ou ligada.
Primeiro, os pesquisadores precisavam encontrar um “contexto” genético que respondesse à pequena molécula interruptora de splicing, quando usada em uma dose baixa. Depois de tratar as células com o composto chamado LMI070, o grupo procurou mudanças nos padrões de splicing em comparação com células não tratadas. O grupo encontrou 45 eventos alterados no splicing de controles versus células tratadas com LMI070. Esses eventos incluíram uma mudança de splicing no gene SF3B3. Ao reanalisar os dados publicados de sequenciamento de RNA, eles descobriram que muitos desses eventos, incluindo o SF3BS, foram consistentemente alterados. Em seguida, o grupo analisou a frequência com que essas alterações de splicing ocorreram sem o tratamento com LIM070. Ao analisar esses 45 eventos em 21.504 conjuntos de dados humanos de RNA-seq, a equipe descobriu que a mudança induzida por LMI070 em SF3B3 raramente ocorre naturalmente (sem a presença de LMI070). Finalmente, o grupo descobriu que o tratamento com LMI070, na dose que leva a mudanças robustas no splicing SF3B3, causou mudanças mínimas na expressão gênica. Apenas cinco genes upregulated e nove downregulated foram identificados. Este trabalho mostrou que o evento de splicing SF3B3 é um “contexto” genético altamente seletivo, responsivo a baixas doses de LMI070 e que o tratamento com LMI070 causou efeitos fora do alvo mínimos – uma característica muito procurada para trocas de terapia gênica.
Para obter o controle da terapia gênica, o grupo criou um éxon sintético que contém o sinal de onde começar a produzir uma proteína. Eles inseriram este éxon sintético dentro do contexto genético de SF3B3 que responde a LMI070. Essa sequência genética combinada foi chamada de Xon. Nesse sistema, o tratamento com LMI070 levou à inclusão do éxon sintético no mRNA maduro e à produção de um repórter, a proteína fluorescente verde (GFP). O repórter GFP permite que os pesquisadores rastreiem o nível de controle que eles têm sobre o sistema. Sem LMI070, não há produção de GFP.
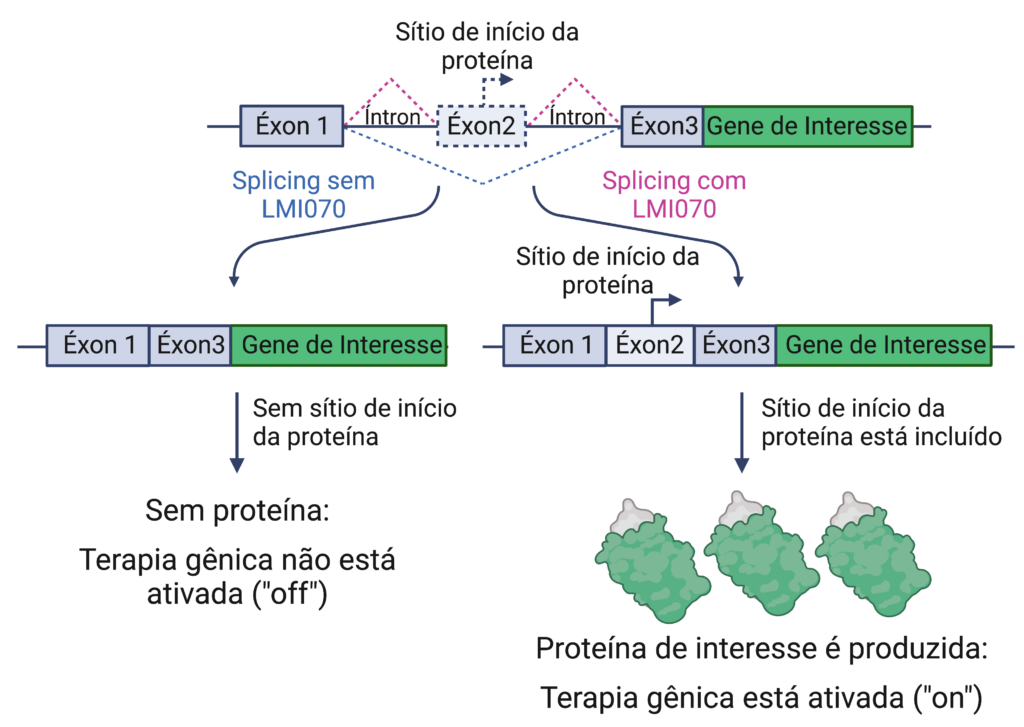
Sistema Xon : Uma pequena molécula induzível por terapia gênica muda os Exons 1, 3 e ambos os íntrons são derivados da sequência SF3B3 que sofre alterações de splicing em resposta a LMI070. O exon 2 é um exon sintético que inclui o sinal de onde começar a produzir a proteína e só é incluído quando o LMI070 está presente. O gene de interesse é a sequência utilizada para terapia gênica, como a eritropoetina, ou um repórter, como o GFP. As linhas pontilhadas indicam quais seções são cortadas com e sem o tratamento com LMI070. A ilustração foi criada pela Dra. Hannah Shorrock e pela Dra. Larissa Nitschke usando Biorender.com.
Usando um vetor AAV viral, a sequência Xon GFP foi dada a camundongos de tipo selvagem usando uma via de administração típica para terapia gênica. Quatro semanas depois, os camundongos foram tratados uma vez com LMI070 oral ou uma solução de controle. O segundo grupo de camundongos recebeu a primeira dose no mesmo momento e, uma semana depois, recebeu uma segunda dose oral de LMI070 ou solução de controle. A GFP foi detectada apenas nos camundongos que receberam LMI070 e foi detectada em vários órgãos, incluindo fígado, músculo e coração em um estudo e cérebro em outro. A quantidade de GFP detectada após cada dose de LMI070 foi semelhante. Juntos, isso indicou que o switch de terapia gênica Xon -LMI070 é capaz de induzir a expressão robusta da terapia gênica e que sem o tratamento LMI070, a terapia gênica é inativa.
Para testar este sistema em um contexto de doença, o grupo usou um sistema AAV Xon para fornecer eritropoietina, que é usada para tratar a anemia associada à doença renal crônica. Após o tratamento com LMI070, foi detectado um aumento de 25 a 62 vezes nos níveis plasmáticos de eritropoietina, com retorno aos níveis basais cinco dias após a retirada do LMI070. Este efeito foi dependente da dose de LMI070 administrada. Por fim, o grupo também testou a capacidade do Xon -LMI070 de controlar a expressão da edição de genes mediada por CRISPR. Várias semanas após a administração intravenosa da sequência Xon -CRISPR, LMI070 foi administrado. Sete dias depois, o grupo detectou a alteração específica no código genético induzida pelo CRISPR, indicando que o interruptor Xon -LMI070 pode ser usado para regular a expressão de uma variedade de abordagens de tratamento baseadas em terapia gênica. Juntos, isso mostra que o nível de expressão da terapia gênica e o período de tempo em que a terapia gênica está ativa podem ser controlados pelo sistema Xon -LMI070.
Ao demonstrar que o interruptor Xon -LMI070 pode ser usado para regular o tempo e os níveis de expressão de diferentes abordagens de terapia gênica em diferentes sistemas de órgãos, o grupo ampliou bastante a possível utilidade das abordagens dessa terapia. Para algumas proteínas, há uma janela muito pequena para a qual a expressão da proteína é bem tolerada pela célula: por exemplo, proteína pode levar a uma doença, enquanto muito pode ter diferentes consequências negativas. Embora esse tipo de sistema baseado em interruptor leve tempo para se traduzir na clínica, o trabalho aqui fornece uma base sólida para o controle de ajuste fino das abordagens de terapia gênica.
Palavras-chaves
Splicing: o processo no qual um transcrito de RNA mensageiro recém-criado é convertido em um RNA mensageiro maduro. Durante o splicing, seções do código genético no RNA mensageiro recém-criado – chamadas de íntrons – são removidas entre as seções chamadas de éxons. Ao unir os exons novamente, um mRNA maduro é produzido.
Éxon: regiões do genoma que estão presentes no mRNA maduro. As proteínas são codificadas pelo material genético localizado em éxons. Nem todos os exons codificam proteínas.
Íntron: regiões localizadas entre os éxons que não codificam proteínas. Os íntrons interrompem a sequência que compõe um gene.
Sequenciamento de RNA: técnica de sequenciamento de próxima geração que quantifica quais RNAs estão presentes em uma amostra biológica e a quantidade desses RNAs.
Declaração de Conflito de interesse
O autor e o editor declaram não haver conflito de interesses.
Citação do artigo revisado
Monteys, A. M., Hundley, A. A., Ranum, P. T., Tecedor, L., Muehlmatt, A., Lim, E., Lukashev, D., Sivasankaran, R. & Davidson, B. L. Regulated control of gene therapies by drug-induced splicing. Nature 596, 291-295, doi:10.1038/s41586-021-03770-2 (2021).

Interrupciones en las repeticiones están asociadas con ataques epilépticos en SCA10
Escrito por Dr Hannah ShorrockEditado por Larissa NitschkeTraducido por Ismael Araujo-Aliaga Interrupciones en las repeticiones en SCA10 influyen en la estabilidad del tramo repetido y están asociadas con ataques epilépticos Read More…


Genetic variants in the NPTX1 gene cause cerebellar ataxia
Written by Dr. Hannah K Shorrock Edited by Dr. Celeste Suart Three genetic variants in the NPTX1 gene have been linked to cerebellar ataxia, providing a genetic diagnosis for seven Read More…


Cientistas desenvolvem uma nova abordagem para avaliar ataxia em casa
Escrito por Ziyang ZhaoEditado por Dr. Hayley McLoughlinTraduzido para o Português por Priscila Pereira Sena Um aplicativo para celulares recentemente desenvolvido permitirá aos pacientes avaliar a ataxia em casa. Há Read More…









